肺癌是全球发病率和死亡率最高的恶性肿瘤,占所有癌症死亡的近20%,预计到2030年底,中国肺癌死亡率将达到40%,癌症相关负担给整个社会带来不可估量的损失[1]。在过去的10多年时间里,肺癌的标准治疗在包括手术、放疗、化疗、靶向治疗、免疫治疗等方面均取得显著成效,延长了患者的总生存期。但临床上仍存在化疗药物毒副作用大、靶向药物耐药、免疫治疗获益人群较少等现实问题,因此寻找更加安全、有效、可靠的组合药物成为临床亟需解决的问题。
白藜芦醇是从虎杖、葡萄、蓝莓、覆盆子等植物中提取的多酚类有机化合物,具有多种药理活性,包括抗炎、抗氧化、抗肿瘤、神经保护、改善缺血损伤等[2]。近年来白藜芦醇抗癌药理作用及机制受到关注,但现有的研究报道缺少针对白藜芦醇抗肺癌药理作用及其机制的系统梳理[3]。本研究聚焦国内外白藜芦醇抗肺癌药理作用及其机制的研究进展,为其在防治肺癌中的进一步研究以及抗肺癌新药研发提供参考。
恶性增殖是肿瘤细胞难以彻底清除的根本原因之一[4]。Yuan等[5]报道用不同浓度(25、50、100、150 μmol·L-1)白藜芦醇处理肺癌A549细胞24、48、72 h,噻唑蓝(MTT)比色法结果显示,白藜芦醇能以浓度和时间相关的方式抑制A549细胞的细胞活力。此外本研究还发现白藜芦醇通过下调细胞周期蛋白(cyclin)D1、细胞周期蛋白依赖激酶(CDK)4和CDK6,上调p21和p27的表达,使细胞周期停滞在G0/G1期。白藜芦醇干预细胞周期,还可能与应激活化蛋白激酶(JNK)/细胞外调节蛋白激酶(ERK)/调节转录因子1(ELK-1)信号通路,增加生长停滞和DNA损伤诱导蛋白45α(GADD45α)蛋白水平,阻滞细胞G2/M转变周期密切相关[6]。
Chen等[7]报道用不同浓度(12.5、25、50 μmol·L-1)白藜芦醇处理肺癌A549细胞24 h后,可显著增加肿瘤抑制因子Rad9 mRNA和蛋白质水平,同时提高活性氧(ROS)水平,触发DNA损伤反应,诱导细胞衰老。
王卫华等[8]报道白藜芦醇质量浓度100 μmol·L-1、作用时间12~48 h,核因子-κB(NF-κB)mRNA的表达随作用时间的延长而逐渐下调,并在48 h时对A549癌细胞增殖抑制率最显著,达到56.3%。
无氧糖酵解是肿瘤细胞物质代谢的主要方式之一,为恶性增殖提供源源不断的能量[9]。己糖激酶II(HK2)是催化无氧糖酵解过程的关键限速酶[10]。Li等[11]在体外细胞实验中使用不同浓度(25、50、100 μmol·L-1)白藜芦醇处理3种非小细胞肺癌(NSCLC)H460、H1650和HCC827细胞24 h,结果发现即使在较低浓度(25、50 μmol·L-1)下,白藜芦醇仍能有效抑制NSCLC的生长,进一步实验发现,高浓度白藜芦醇能调节蛋白激酶B(Akt)信号通路,致使己糖激酶2(HK2)表达下调,糖酵解速率减慢。
黎展华团队[12-14]的细胞实验证实100 μmol·L-1白藜芦醇对A549细胞具有更强的生长抑制作用,作用机制可能是高浓度白藜芦醇上调微小RNA(miR)-506,通过鞘氨醇激酶1(SPHK1)/Akt/NF-κB通路下调SPHK1蛋白和NF-κB P65蛋白表达,抑制肿瘤细胞增殖,且随着处理时间延长,蛋白质相对表达量降低,抑制增殖作用越明显。
侵袭和转移是癌细胞的重要生物学行为,抑制肿瘤细胞的迁移和侵袭是白藜芦醇发挥抗肺癌活性的重要机制之一。Lin等[15]用100 μmol·L-1白藜芦醇处理肺癌A549细胞16 h,结果发现白藜芦醇能减弱癌细胞运动能力,进一步探索证实白藜芦醇抗癌细胞侵袭、转移能力与白藜芦醇通过泛素蛋白酶体途径抑制癌细胞中金属蛋白酶9(ADAM9)蛋白的表达有关。
黎展华等[16]使用不同浓度(30、50、100 μmol·L-1)白藜芦醇处理肺癌A549细胞48 h后,运用划痕实验和Transwell侵袭实验检测A549细胞的侵袭和迁移能力。结果表明,与空白对照组比较,不同浓度白藜芦醇组的迁移面积均明显缩小,侵袭能力明显降低,且具有浓度相关性。其作用机制可能是白藜芦醇通过磷酸鞘氨醇(S1P)/磷酸鞘氨醇受体3(SIPR3)通路抑制A549细胞迁移及侵袭。
Liu等[17]使用不同浓度(12.5、25、50、100 μmol·L-1)白藜芦醇处理肺癌A549细胞24 h后,癌细胞的侵袭和迁移能力呈剂量相关性下降。作用机制可能是白藜芦醇通过抑制血红素加氧酶1介导的NF-κB通路,进而下调基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)的表达,抑制人肺腺癌细胞转移。
上皮间质转化是上皮细胞转化为活跃的间质细胞的过程,这一过程增强了癌细胞的侵袭和转移能力。Wang等[18]用20 μmol·L-1白藜芦醇处理肺癌A549细胞24 h,结果发现白藜芦醇能下调锌指转录因子(Snail)1和Slug等上皮间质转化诱导因子表达,抑制转化生长因子-β1(TGF-β1)诱导的上皮间质转化。
肿瘤血管可以持续不断地为肿瘤生长提供营养和氧气,并及时排出代谢废物。如果没有建立血管系统,原位和转移的肿瘤细胞增殖速度将受到明显抑制[19]。血管内皮生长因子(VEGF)是肿瘤血管生成中最典型的调节因子,可介导血管通透性和血管生成。Wang等[20]用250 μmol·L-1白藜芦醇对原位NSCLC模型大鼠连续ig给药12周,发现白藜芦醇组肺质量指数、肺肿瘤负荷、VEGF-mRNA及蛋白水平较空白对照组均明显降低。
血小板是肿瘤微环境中的活性成分,参与多种肿瘤过程调节,也包括血管生成[21]。He等[22]报道40 μmol·L-1白藜芦醇在体外可抑制A549细胞诱导的血小板血管生成潜力,进一步的裸鼠实验证实,10 mg·kg-1白藜芦醇可下调VEGF水平,抑制肿瘤血管生成。
细胞凋亡和细胞自噬是基因控制的细胞程序性死亡,也是一种细胞降解途径,在维持细胞稳态方面有重要作用[23]。李王平等[24]使用不同质量浓度(20、30、40 μg·mL-1)白藜芦醇处理H446细胞24 h,结果发现随着白藜芦醇浓度增加,细胞内ROS释放和线粒体膜电位下降增加,细胞凋亡数量增加。张云珍等[25]报道50 μmol·L-1白藜芦醇作用A549细胞24 h,与空白对照组比较,白藜芦醇组A549细胞中自噬关键分子酵母Atg6同系物(Beclin 1)、微管相关蛋白1轻链3(LC3)Ⅱ/Ⅰ表达升高和促凋亡Bcl-2相关X蛋白(Bax)、活化半胱氨酸蛋白酶-3(caspase-3)表达升高。
Wright等[26]用不同浓度(50、100、200 μmol·L-1)白藜芦醇处理H460细胞12 h,结果表明白藜芦醇可通过死亡受体途径触发半胱氨酸蛋白酶-8(caspase-8)激活和凋亡抑制蛋白(c-FLIP)下调,从而诱导H460细胞凋亡。闫菊等[27]使用10、20、40 μmol·L-1白藜芦醇处理H292细胞48 h,结果显示白藜芦醇以剂量相关的方式诱导细胞核和线粒体中LC3阳性自噬小体显著增加,诱导细胞发生自噬。
Li等[28]用不同浓度(25、50、75 μmol·L-1)白藜芦醇处理A549细胞48 h,与空白对照组比较,细胞自噬生物标志物Beclin 1和LC3B的mRNA和蛋白水平显著升高,白藜芦醇诱导的细胞自噬呈剂量相关。
磷酸肌醇3-激酶(PI3K)/Akt通路是细胞内信号转导经典信号通路之一,作用于细胞自噬、凋亡等重要细胞生物学过程[29]。Li等[30]报道40 μg·mL-1白藜芦醇处理H446细胞24 h,发现白藜芦醇可通过PI3K/AKT/c-Myc通路促进H446细胞凋亡。Li等[31]使用100 μmol·L-1白藜芦醇处理A549细胞24 h,发现白藜芦醇可抑制蛋白精氨酸甲基转移酶5(PRMT5)/AKT/糖原合成酶3(GSK3)信号通路促进肺癌细胞凋亡。
表皮生长因子受体(EGFR)敏感突变在NSCLC中占10%~15%[32]。EGFR酪氨酸激酶抑制剂(EGFR-TKIs)能特异性靶向肿瘤细胞,且不良反应较少,在临床上广泛应用,被推荐作为EGFR敏感突变晚期NSCLC的一线治疗[33]。长期临床实践发现EGFR-TKIs也存在耐药性问题,克服其耐药性是临床研究的热点问题。先前研究表明,吉非替尼获得性耐药的机制主要涉及EGFR T790M突变[34]、间质表皮转化因子(MET)扩增[35]、干细胞生长因子(HGF)过表达[36]、单细胞色素P4501A1(CYP1A1)介导的代谢增加[37]和三磷酸腺苷结合盒家族G2(ABCG2)或ABCB5介导的外排增强有关[38]。Zhu等[39]报道40 μmol·L-1白藜芦醇和1 μmol·L-1吉非替尼共处理A549细胞24 h,联合用药组CYP1A1和ABCG2的表达均比单独吉非替尼组治疗降低83%和67%,吉非替尼的代谢和外排减少,吉非替尼浓度增加,同时抑制EGFR磷酸化。
Lu等[40]报道5 μmol·L-1白藜芦醇和10 μmol·L-1吉非替尼共处理H1299和PC‐9/GR两种吉非替尼耐药细胞48 h,结果发现联合用药组通过上调miR‐345和miR‐498,抑制蛋白激酶(MAPK)/c-Fos和AKT/B淋巴细胞瘤2(Bcl-2)信号通路,克服H1299和PC‐9/GR细胞对吉非替尼的耐药。张红萍等[41]报道0.01 μmol·L-1吉非替尼和10 μmol·L-1白藜芦醇处理PC-9肿瘤细胞48 h,研究证明白藜芦醇通过下调MET蛋白的表达增强吉非替尼对PI3K/AKT途径的抑制作用,进而诱导肿瘤细胞凋亡。Nie等[42]报道20 μmol·L-1白藜芦醇和10 μmol·L-1厄洛替尼共处理PC-9/ERL厄洛替尼耐药细胞48 h,研究发现白藜芦醇通过下调存活蛋白和上调凋亡调控因子(PUMA)协同增强厄洛替尼介导的细胞凋亡效果。
晚期肺癌的化疗药物多以铂类和紫杉醇为主,具有抗癌谱广,作用强的特点。Lin等[43]在体外细胞实验中使用50 μmol·L-1白藜芦醇和20 μmol·L-1顺铂共处理A549细胞48h,与单用顺铂组相比,联合组能抑制含SAM尖端结构域的E26转化特异性因子(SPDEF)/黏蛋白5AC(MUC5AC)轴激活,增强顺铂敏感性。
Li等[44]和Ma等[45]观察不同质量浓度(35、40、55 μg·mL-1)白藜芦醇和5 μg·mL-1顺铂联合用药组分别作用于H446、H838和H520细胞24 h的效果。结果发现白藜芦醇增强了顺铂对癌细胞的敏感性,具体机制包括生长抑制、ROS产生、线粒体去极化、下调Bcl-2和Bcl-xL和上调Bax等。Kong等[46]研究发现10 μg·mL-1白藜芦醇和10 μg·mL-1紫杉醇联合处理A549细胞24 h,白藜芦醇通过下调环氧化酶2(COX-2)相关基因增强紫杉醇的抗癌效果。
Hou等[47]报道100 μmol·L-1白藜芦醇和
10 μmol·L-1阿霉素共处理H69AR阿霉素耐药细胞24 h,研究发现白藜芦醇可抑制肿瘤微环境中炎症介质的表达水平,从而降低转录激活子3(STAT3)/VEGF介导的H69AR细胞对阿霉素的耐药。陈春苗等[48]报道20 μmol·L-1白藜芦醇和10 μmol·L-1顺铂联用可通过PI3K/AKT/哺乳动物雷帕霉素靶蛋白(mTOR)通路,促进NSCLC耐顺铂细胞株A549/DDP细胞自噬诱导细胞凋亡。
吴异兰等[49]报道2.5 μg·mL-1紫杉醇和20 μmol·L-1白藜芦醇联用可通过促进Bax、caspase-3表达,下调Bcl-2表达,提高肺腺癌紫杉醇耐药细胞A549/Taxol-R细胞对紫杉醇的敏感性。
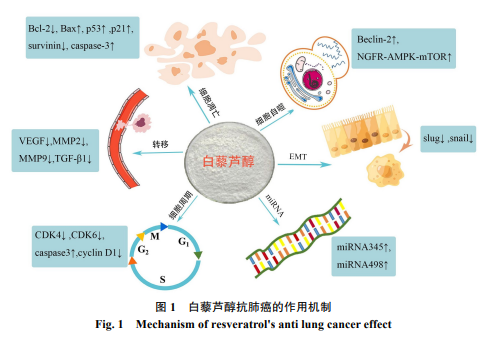
值得注意的是,白藜芦醇可通过多种方式发挥抗肺癌作用,笔者将白藜芦醇抗肺癌作用机制归纳见图1,向上的箭头代表上调,向下的箭头代表下调。
白藜芦醇抗肺癌药理作用广泛,在多种肺癌细胞中均表现出显著的抗肿瘤活性[50]。白藜芦醇通过干预细胞周期,靶向无氧糖酵解,抑制癌细胞增殖;通过抑制ADAM、MMP和Snail相关蛋白表达等,弱化癌细胞的侵袭和转移能力;通过影响化疗和靶向药物耐药的关键基因,增强药物敏感性;通过影响凋亡途径,调控相关转录因子,影响抗凋亡蛋白Bcl-2和Bcl-xL和促凋亡蛋白Bax的平衡及caspase的表达,诱发细胞凋亡。这些作用机制相互影响、相互调控,共同发挥抗肺癌的作用,已经成为当前抗癌新药研发的潜在热点药物之一。
目前对于白藜芦醇抗肺癌药理作用及机制研究尚存有不足之处:(1)白藜芦醇发挥抗肺癌作用时呈明显的时间和浓度相关性,作用时间和浓度尚不明确;增强化疗药物和靶向药物敏感性的药物浓度也不明晰,所以未来需要更多的大型随机对照试验去进一步明确其有效剂量和作用时间;(2)现有研究多集中在体外细胞层面,细胞种类较多,较少研究进行体内实验验证,未来应从动物实验入手进一步解释其作用机制;(3)白藜芦醇存在生物利用率低、代谢快及体内分布有限的问题,未来应该把重点放在研发制备白藜芦醇类似物或负载白藜芦醇的新材料以提高其生物利用度;(4)白藜芦醇抗肺癌作用机制复杂,缺乏完善的系统网络,未来应该利用现代技术手段分析其作用机制,为临床新药的开发提供更可信的数据支持,促进白藜芦醇相关制剂的临床使用,以使更多的肿瘤患者受益。
来 源:房立源,王润兮,方宇航,张英.白藜芦醇抗肺癌作用及其机制的研究进展 [J]. 药物评价研究, 2023, 46(10): 2277-2283.